記者簡浩正/台北報導
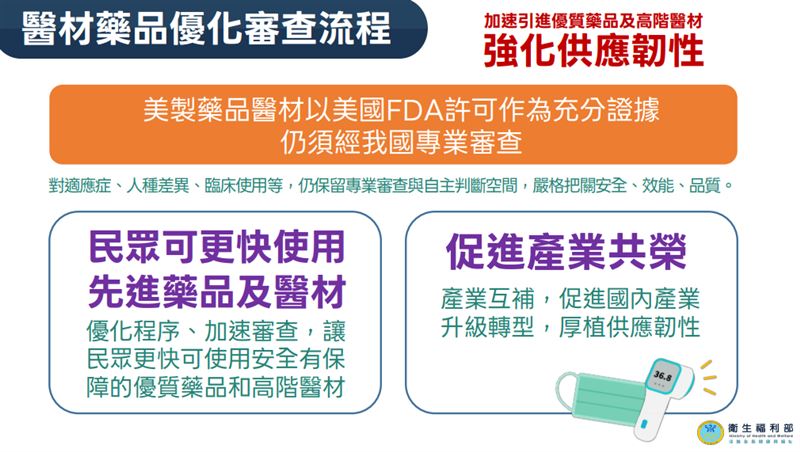
「台美對等貿易協定(ART)」今(13)日完成簽署。衛福部食品藥物管理署表示,因應關稅協定,未來通過美國食品藥物管理局(FDA)審查藥品,可以美國藥證為證據,檢附相關資料,如已做過人種差異臨床試驗,在台灣可不必再做臨床試驗,實際情形將依個別藥品情況評估。
食藥署表示,台美完成對等貿易協定簽署,三大重點包含加速先進美製醫藥品審查、維持基因改造食品輸入管理未變且進一步加強邊境混摻通報;以及美牛、美豬管理接軌國際標準,並堅持「四大不變」,分別是敏感品項禁令不變、原產地標示不變、校園採購國產不變、食安管理機制不變,堅守保障國人健康立場。

食藥署副署長王德原表示,健保給付醫藥品接軌國際是病友團體長期訴求,美國作為全球醫療科技強國,未來通過美國食品藥物管理局(FDA)審查的美國製造醫療器材與藥品,可以美國上市許可作為申請我國許可證時的充分證據,但適應症、人種差異、臨床使用等仍須通過我國專業審查,加速民眾使用安全有保障的優質藥品與高階醫材。此外,建置自費醫材核價單一平台,無須22縣市逐一審,簡化程序,加速臨床應用。
在食品方面,她說我國對於基改食品管理規定未變,產品仍須於上市前經過嚴謹的查驗登記審查,含基改食品原料的產品也要清楚標示,資訊透明提供民眾辨識選擇。同時台美建立資訊交換機制,邊境發現未核准基改產品有少量非故意摻雜情形,會立即啟動通報處理,強化把關。























